한국생명공학연구원은 기존 '크리스퍼 유전자 가위'의 한계를 극복한 고효율 다중 유전자 편집 기술을 개발했다고 24일 밝혔다.
유전자가위는 인간·동식물 세포의 특정 염기서열을 찾아내 해당 부위 디옥시리보핵산(DNA)을 절단함으로써 유전체를 교정하는 기술이다.
대표적으로 '크리스퍼 카스9 유전자가위'(CRISPR-Cas9)가 널리 활용되고 있는데. 절단 효소인 카스9 단백질과 교정할 유전자 부위를 찾아주는 '가이드 리보핵산(RNA)'이 결합해 유전체를 편집하는 방식으로 작동한다.
다만 한꺼번에 발현된 여러 개의 가이드 RNA를 카스9 단백질과 결합하려면 RNA 분해효소(RNase)로 절단해줘야 하는데, 서열이 반복된 형태로 너무 비슷한 탓에 기존 분해효소로는 효과적으로 절단하기 어려웠다.
이에 따라 기존 크리스퍼 유전자 가위는 DNA 합성에 실패하거나 재조합에 오류가 발생하는 등 한계가 있었다.
이대희 박사 연구팀은 외부 유도물질 없이도 스스로 RNA를 절단할 수 있는 효소 역할을 하는 RNA인 '리보자임'을 이용, 안정적으로 여러 개의 가이드 RNA를 만들어내는 데 성공했다.
반복되는 RNA 배열은 물론 비(非) 반복 RNA 배열을 만들어냄으로써 동시에 여러 개의 유전자를 편집할 수 있을 뿐만 아니라 유전자 합성의 복잡성을 줄여 편집 실패율을 대폭 낮췄다.
실제 대장균에 적용해 실험한 결과 한 번에 6개 이상의 유전자를 동시에 편집할 수 있어 부티르산(항염증과 장 건강 개선 효과가 있는 기능성 미생물 대사산물) 생산량을 최대 7배 높일 수 있었다.
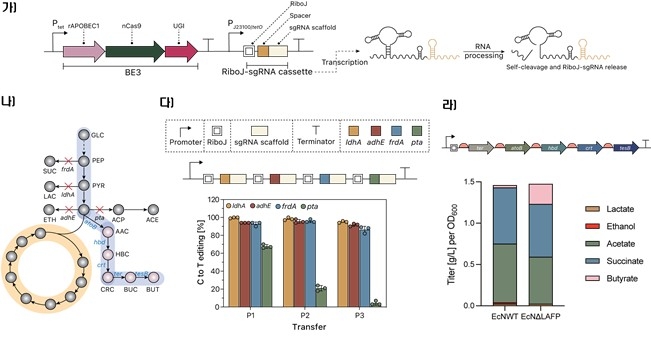
아세트산 소비도 조절함으로써 아세트산 대사 경로(세포가 아세트산을 에너지원으로 활용하는 대사 경로로, 탄소 자원의 손실을 줄일 수 있음)를 최적화하는 데 성공했다.
첨단 유전체 기술은 물론 다양한 의료용, 산업용 미생물 개발 등에 활용할 수 있을 것으로 기대된다.
이대희 박사는 "크리스퍼 유전자가위로 여러 개의 유전자를 동시에 편집할 때 가장 문제가 됐던 가이드 RNA의 합성과 배열 문제를 합성생물학 기술을 이용해 해결했다는 점에서 큰 의미가 있다"고 연구 의의를 밝혔다.
이번 연구 성과는 국제 학술지 '케미컬 엔지니어링 저널'(Chemical Engineering Journal) 지난 7일 자 온라인판에 실렸다.
- 연합뉴스
- 저작권자 2025-04-25 ⓒ ScienceTimes
관련기사

 뉴스레터
뉴스레터