얼마 전 알츠하이머병의 원인이 아밀로이드 베타 단백질이 아니라 타우(Tau) 단백질이라는 주장이 제기된 가운데, 미국 라이스대 연구진은 최근 새로운 시뮬레이션을 통해 타우 단백질이 알츠하이머 치매와, 치매의 일종인 픽(Pick) 질환을 일으키는 경로를 새로 제시했다.
연구팀은 과학저널 ‘미국 국립과학원회보’(PNAS) 3일 자에 발표한 논문에서, 타우 단백질이 알츠하이머병과 전측두엽 치매(frontotemporal dementia)로 알려진 픽 병을 유발, 촉진시키는 것으로 의심되는 응집체를 각각의 두 가지 경로를 통해 형성한다고 보고했다.
이같이 다른 경로가 형성되는 이유는 아직 미스터리로 남아있으나, 질병 경로를 구체적으로 밝히면 질병을 통제할 수 있는 가능성을 높일 것이라고 연구팀은 제안했다.
타우 단백질은 특히 뉴런에서 일차적으로 미세소관(microtubules)을 조절하는 일을 하는 것으로 알려져 있다. 이 미세소관은 세포 안에서 화물을 실어 나르는 통로 역할을 하고 세포 분열을 용이하게 하는 실 모양의 작은 구조물이다.
이들은 이미 규명된 것과 같이 여러 형태로 존재하고, 별개의 방법으로 응집될 수 있다.

타우가 향하는 두 가지 경로
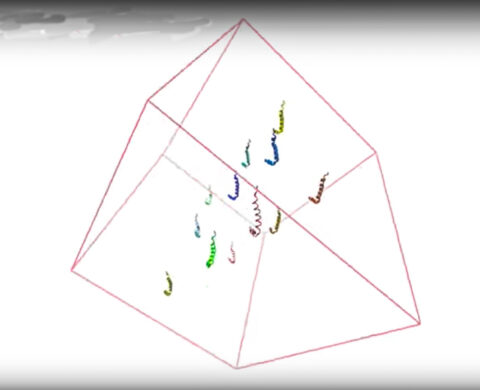
라이스대 생물물리학자인 피터 월라인스(Peter Wolynes) 박사팀은 이번 연구에서 처음으로 전산 분석을 통해 알츠하이머병 환자와 픽 병 환자들의 뇌에서 발견되는 고형의 작은 섬유들과, 이와 달리 뉴런의 세포질에 떠다니는 무질서한 회전초(tumbleweed) 같은 덩어리를 형성하는 단백질을 구별해 냈다.
라이스대 이론 생물 물리학센터 공동 원장인 월라인스 박사는 “막이 없는 소기관(회전초)으로 변환되는 형태와 섬유가 되는 형태 사이에는 관계가 있다”고 말하고, “동일한 타우 분자가 따를 수 있는 두 가지 뚜렷한 경로가 있는 것으로 보이며, 두 경로 사이의 균형은 일부 생물학적 과정의 영향을 받는다”고 설명했다.
월라인스 박사는 이 모델들을 보면 수많은 세포 신호 과정을 조절하는 인산화(phosphorylation)가 그 결정 요인임을 짐작할 수 있다고 말했다.
그는 “일단 이들 응집체 중에 어떤 것이 실제로 나쁜 것인지를 알아내면 균형을 바꾸기 위해 인산화 과정 자체에 개입하는 것이 가능하다”고 밝혔다.
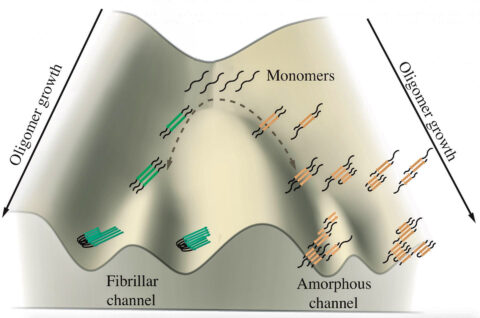
타우 단백질의 과인산화가 질병 유발?
연구팀은 결이 거친 AWSEM(연관 메모리, 물 매개, 구조와 에너지 모델) 분석 도구를 사용해 환자들로부터 나타난 변이체를 토대로 한 다양한 타우 단백질 모델에서 단백질들이 어떻게 접히는지를 예측할 수 있었다.
월라인스 교수는 “인산화가 무정형 응집체 형성을 촉진하고, 섬유 형성은 그런 정도로까지 촉진하지는 않는다는 사실을 발견했다”고 말했다.
인산화도 물론 궤도를 벗어날 수 있다는 게 그의 의견이다.
그는 “타우 단백질을 따라 인산화될 수 있는 부위가 20개 정도 되지만, 일반적으로는 4~5개만이 인산화된다”며, “때때로 과정에 관여하는 효소들이 더 많은 일을 해 과인산화되기도 하는데, 5개 대신 10개 부위가 인산화되면 효과가 나타날 수 있다”고 밝혔다.
그는 또 “만약 여분의 인산화가 더 많은 질병을 유발할 수 있다면, 어떤 키나아제 효소가 인산화를 일으키는지를 찾아 암을 치료할 때와 같이 약물로 이를 억제하기를 원할 것”이라고 덧붙였다.
타우 단백질 연구의 도전 과제
타우 단백질은 역추적(backtracking)이라는 또 다른 흥미로운 특성을 보여주었다. 이것은 과학자들이 알츠하이머병과 관련된 아밀로이드 베타 펩타이드에서 발견한 것과 같은 것이다.
둘 다 부분적으로 접히지 않도록 에너지 장벽이 힘을 가할 때까지 응집되는 경향이 있고, 그런 다음 가장 안정된 최종 형태로 가는 또 다른 경로를 모색한다.
월라인스 교수는 응집되는 타우 단백질들이 서로 다른 방향으로 가지를 치는 것처럼 보이는 것은 방해받는 지점에 있는 것이라고 지적했다.
한 세트의 타우가 느슨하게 떠다니는 덩어리로 응집되는 동안, 다른 세트의 타우는 환자들의 뇌에서 관찰된 정렬된 플라크로 응집되는 평행한 작은 섬유들을 형성한다.
연구팀은 역추적 메커니즘이 미래 연구의 한 주제인 단백질 응집의 보편적 특성이 될 수 있을 것이라고 제안했다.
월라인스 교수는 느슨한 응집체들이 연구자들에게는 또 다른 도전 과제가 될 수 있다고 말했다.
그는 이들에 관한 물리학적 의문으로 “이 응집체들이 국지화되었으나 왜 모두 함께 붙어서 하나의 큰 세포 소기관을 형성하지 않고 물 위의 기름방울처럼 동떨어져 있는가? 이들이 떠돌아다니는데 왜 시간이 오래 걸릴까? 이들은 계속해서 만들어지고 분해되는 것인가? 그리고 이들의 크기는 어떻게 결정되는가?”하는 질문을 던졌다.
월라인스 교수는 “이 시점에서 그것은 여전히 매우 기초적이며 단순한 이야기”라고 말하고, “이제까지 우리가 배운 것은 매우 간단하지만, 타우의 실제 이야기는 아직도 매우 복잡하다”고 말했다.
- 김병희 객원기자
- hanbit7@gmail.com
- 저작권자 2020-02-05 ⓒ ScienceTimes
관련기사

 뉴스레터
뉴스레터