영국 케임브리지대학의 과학자들이 기존 미생물과 전혀 다른 유전자지도(DNA code)를 지닌 살아 있는 미생물을 만들어내는데 성공했다.
16일 ‘뉴욕타임스’, ‘가디언’ 지 등 주요 언론에 따르면 이 살아있는 인조 유기체는 외형적으로는 토양이나 사람의 소화기관 내에 살고 있는 세균과 유사하지만 새로운 유전명령(genetic instructions)에 따라 세포 활동을 하고 있는 중이다.
이번 연구 결과는 향후 새로운 유전자지도(DNA code)에 의해 또 다른 생명이 존재할 수 있다는 사실을 말해주는 것이다.
또한 새로운 유전자지도에 의해 새로운 생물학적 체계를 지니고 있는 유기체를 제작할 수 있을 것으로 기대되고 있다. 특히 이 방식을 통해 항바이러스‧항박테리아성 물질과 의약품을 만들어낼 수 있으며, 더 나아가 불치병 치료의 큰 역할을 할 수 있을 것으로 전망된다.

새로운 염기서열의 미생물 ‘합성’
연구진은 이 인공 미생물 제작을 위해 케임브리지 대학 분자생물학연구소에서 약 2년 간 노력을 기울여왔다.
먼저 대장균(E coli)의 유전자지도를 읽은 후 이를 근거로 기존의 대장균과 매우 다른 패턴의 유전자지도를 지닌 새로운 미생물을 재설계했으며, 이 설계도를 근거로 이전에 볼 수 없었던 새로운 세포를 창조할 수 있었다.
연구팀은 이 미생물의 DNA가 400만 개의 염기로 구성돼 있으며, 꼬불꼬불 뒤엉켜 한 쌍을 이루고 있다고 밝혔다. DNA 유전암호인 G‧A‧T‧C 서열 정보를 A4 용지에 인쇄했을 때 970쪽의 분량이 나올 만큼 매우 큰 미생물이라고 밝혔다.
연구를 이끈 합성생물학자 제이슨 친(Jason Chin) 교수는 “연구를 시작할 당시 이처럼 큰 미생물을 만들어낼 수 있을지, 또한 기존 미생물과 다른 새로운 염기서열의 미생물을 만들어낼 수 있을지 불확실했지만 끈질긴 실험을 통해 이 일을 완성할 수 있었다”고 말했다.
이번 연구를 지켜본 임페리얼칼리지런던의 합성생물학자 톰 엘리스(Tom Ellis) 교수는 “다른 어떤 연구진도 인공적으로 이렇게 큰 미생물을 시도한 일조차 없었다”며, 케임브리지대 연구 결과에 대해 놀라움을 표명했다.
케임브리지대 연구진은 9년 전에 100만 개의 염기로 구성된 미생물을 제작한 바 있다. 대장균을 모방한 이 미생물은 기존의 미생물과 비교해 너무 작아 큰 관심을 불러일으키지 못했다.
지난 2010년 미국의 과학자들도 합성 유전체를 지닌 미생물을 제작한 바 있다. 우폐역(Mycoplasma mycoides)을 모방해 만든 것으로 이 역시 너무 작아 활용성에 의문이 제기됐었다.
이번에 제작한 미생물은 크기에 있어 다른 미생물들보다도 더 큰 신종 미생물이다. 연구 논문은 ‘네이처’ 지 15일 자에 게재됐다. 논문 제목은 ‘Total synthesis of Escherichia coli with a recoded genome’이다.
새로운 의약품 개발에 활용할 수 있어
캠브리지대 친 교수는 “이번 미생물 제작에 있어 유전명령(genetic instructions) 설계하는 일이 가장 힘들었다”고 말했다.
생명체를 구성하고 있는 세포가 그 기능을 원활히 수행하기 위해서는 건전한 유전명령(genetic instruction)이 주어져야 한다. 세포의 모든 활동이 유전명령에 따라 이루어지기 때문.
예를 들어 세포가 성장하기 위해 단백질이 필요할 경우 DNA 사슬을 구성하고 있는 특정 염기서열이 전사(transcription)를 지시하게 된다.
전사 지시가 내려지면 단백질 형성을 억제하고 있던 억제자 효소가 떨어져 나가고, RNA 중합효소에 의해 DNA와 상보적인 서열을 갖는 RNA를 생성하는 전사를 시행하게 된다.
RNA 중합효소는 주형이 되는 DNA 사슬과 상보적인 리보뉴클레오타이드를 이용해 전령 RNA를 만든다. 이렇게 만들어진 전령 RNA의 염기서열은 세 개씩 짝을 이뤄 코돈(codons)을 형성한다.
여기서 코돈이란 전령 RNA의 유전암호 단위를 말한다. 이것에 의하여 세포 내에서 합성되는 아미노산의 종류가 결정되고, 또한 후대에 걸쳐 이 유전암호를 전달하게 된다.
지금까지의 연구 결과에 따르면 해파리서부터 사람에 이르기까지 대다수 생물은 전 생애에 걸쳐 64개의 코돈을 사용하고 있는 것으로 밝혀지고 있다.
그중 61개의 코돈은 염주처럼 길게 연결돼 있는 단백질을 생성하는 아미노산의 종류가 결정된다. 또한 이 유전암호에 따라 지속적으로 다양한 단백질을 생성할 수 있다. 나머지 3개의 코돈은 아미노산 생성 임무를 완성했을 때 작업을 중단시키는 일을 맡고 있다.
케임브리지대 연구팀은 대장균(E coli)과 유사하게 유전자지도를 재설계하면서 대장균으로부터 남아도는 코돈을 채취했다. 그리고 채취한 코돈 중 아미노산 종류를 결정하는 코돈인 61개의 TCG를 재구성에 ‘AGC’라고 명명했다.
연구팀은 이런 식으로 3개의 또 다른 활동 억제 역할을 맡고 있는 코돈(TCA)을 제작해 인공 미생물 안에 주입했다. 그리고 1만 8000여 번의 실험을 통해 이전에 존재하지 않았던 새로운 미생물 합성에 성공했다.
연구팀은 ‘네이처’ 지에 게재한 논문을 통해 64개의 코돈을 새로 설계 제작해 주입했으며, 그 결과 유전체로부터 성공적으로 단백질 합성을 진행할 수 있었다고 밝혔다.
또한 생성될 아미노산 종류를 결정하는 61개의 코돈을 대상으로 1만 8214종의 코돈을 재설계할 수 있었다고 말했다. 실제로 새로 제작된 미생물은 59종의 코돈을 사용해 20종의 아미노산을 생성할 수 있으며, 또한 일을 수행하는 전령 RNA 활동을 멈추게 할 수 있다고 밝혔다.
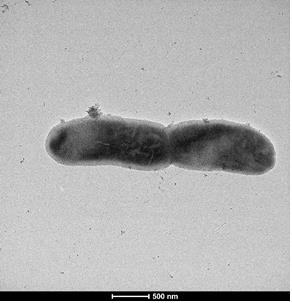
실험을 진행하면서 이 미생물이 살아 있음을 발견한 것은 지난해 성탄절 직전이다.
연구팀은 실험용 플레이트에서 살아서 움직이는 이 미생물을 촬영했다. 친 박사는 “이 인조 미생물의 크기가 기존의 미생물들보다 조금 긴 편이며, 매우 느리게 움직이고 있었는데 살아서 움직이고 있었다”고 말했다.
사람이 제조한 새로운 미생물이 탄생하면서 과학계는 물론 의료계에서 새로운 의약품 개발 가능성을 예고하고 있다.
대장균(E coli)의 경우 이미 당뇨병 치료를 위한 인슐린 제조를 비롯 다양한 암 치료제 개발을 위해 생물약제 산업(biopharmaceutical industry) 분야에서 적극적으로 활용되고 있는 중이다.
이번 연구 결과를 적용해 기존의 대장균 기능 중에 부족했던 점을 보완할 경우 새로운 치료제 개발에 도움을 줄 수 있을 것으로 예상하고 있다.
- 이강봉 객원기자
- aacc409@naver.com
- 저작권자 2019-05-16 ⓒ ScienceTimes
관련기사

 뉴스레터
뉴스레터