장내 미생물군이 우리가 먹는 약을 어떻게 화학적으로 변형 혹은 대사 시켜 약의 효능과 안전성에 영향을 미치는지를 평가할 수 있는 체계적인 방법이 개발됐다.
미국 프린스턴대 연구팀이 제시한 새 방법론은 장내 미생물들이 약을 대사 시키는 방법에 대한 더욱 완벽한 그림을 제공함으로써 더 효과적이고 부작용이 적은 약 개발에 도움을 줄 것으로 보인다.
아울러 앞으로 각 개인의 장내 미생물군(gut micribiome) 특성에 따른 개인 맞춤 의약품도 나올 수 있을 것으로 기대된다. 이번 연구는 생명과학저널 ‘셀’(Cell) 10일 자에 발표됐다.
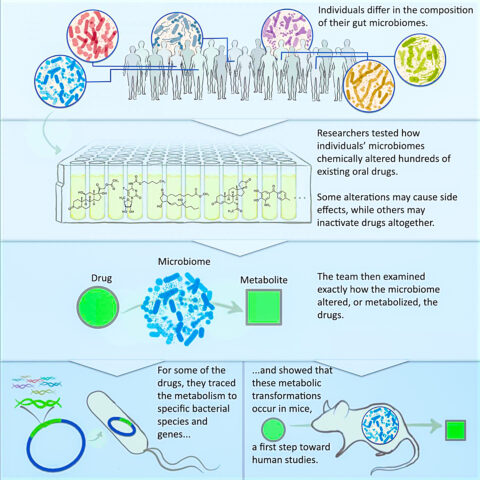
미생물들이 서식하는 대장과 소장은 우리가 먹는 알약이나 액체 약물이 흡수되는 주요 영역이다. 이전의 연구들은 단일 종의 장내 박테리아가 어떻게 이런 경구 약물을 대사 시키는지를 조사했다.
이에 비해 이번 연구는 한 사람의 전체 소화관 내 미생물군집이 미치는 영향을 한꺼번에 평가할 수 있도록 했다.
장내 미생물군이 약물 효과 변경시켜
프린스턴대 분자생물학과 모하메드 도니아(Mohamed S. Donia) 조교수는 “기본적으로 우리는 장내 미생물군의 복잡성을 기피하지 않고 수용했다”며, “이 방법을 통해 미생물군이 약물 대사에 미치는 영향에 대한 전체적이며 더욱 실제적인 견해를 얻게 됐다”고 밝혔다.
연구팀은 이 접근법을 이용해 이미 시중에 나와있는 수백 가지 일반 약물에 대해 장내 미생물군이 미치는 영향을 평가했다.
평가 결과, 연구팀은 장내 미생물군이 기존의 경구 약물을 변경시킬 수 있는 사례 57가지를 확인했다. 이중 80%는 이전에 보고되지 않은 사례로, 약물과 장내 미생물군과의 상호작용을 보여줄 수 있는 새로운 가능성을 보여주었다.
이 같은 약물 변경 사례에는 약을 비활성 상태로 전환시켜 효과를 줄이거나, 독성을 띠게 함으로써 부작용을 일으킬 가능성도 포함됐다.
연구팀은 새로운 평가체제가 약물 개발 초기에 ‘잠재적인 약물과 장내 미생물군 사이의 상호작용’을 식별해 제약 공식이 변경될 수 있다는 사실을 알려주어 약물 개발에 도움을 줄 수 있다고 보고 있다.
또한 임상시험 중인 약물의 독성과 효능을 더욱 잘 분석하는 데도 도움이 될 수 있다는 것이다.
인체의 장에는 수백 종의 박테리아가 서식한다. 이 같은 장 미생물계가 어떤 종류의 박테리아로 얼마나 많은 수로 구성돼 있는가는 사람마다 크게 다를 수 있다.
도니아 교수는 “이 같은 개인 사이의 다양성으로 인해 단일 박테리아 종만을 연구해서는 개인 간 미생물군의 약물 대사 비교가 불가능하다”고 지적하고, “장내 미생물계 전체를 연구해야 한다”고 강조했다.
“장내 미생물군 활용해 개인 맞춤 치료 가능”
연구팀은 일부 사람들의 장내 미생물군은 주어진 약물에 거의 영향을 미치지 않는 반면, 다른 사람들의 미생물군은 심각한 영향을 끼침으로써, 단일 종이 아닌 미생물군이 약물 대사에 매우 중요한 역할을 한다는 사실을 발견했다.
논문 공동 제1저자인 분자생물학과 바하르 자브단(Bahar Javdan) 박사과정생은 “모든 사람들의 미생물군은 고유한 특성을 지녔으며, 이번 연구에서 이를 확인할 수 있었다”고 말했다.
그는 “세 가지 주요 범주, 즉 모든 미생물군에 의해 일관되게 대사 되는 약물과, 일부 미생물들에 의해서만 대사 되는 약물 그리고 어떤 미생물군에 의해 유도된 대사에도 영향을 받지 않는 약물로 구분할 수 있다”고 덧붙였다.
이번의 방법론적 접근법은 각 환자의 장내 미생물군에 대한 개인 맞춤 치료에도 유용할 수 있을 것으로 보인다. 예를 들면 어떤 약물이 어떻게 작용할 것인지를 예측하고 만약 원치 않는 결과가 예견되면 치료 전략을 바꾸도록 제안할 수 있다는 것이다.
논문 공동 제1저자이자 프린스턴대 통합 유전체학 연구소 대학원생인 하이메 로페즈(Jaime Lopez) 연구원은 “이 부분은 약물과 생태학이 충돌하는 사례”라며, “이 미생물계에 속하는 박테리아들은 생존을 위해 서로 돕고 각 세균의 호소 프로필에도 영향을 미치는데, 미생물계를 연구하지 않으면 이런 사실을 결코 포착할 수 없다”고 설명했다.

575개 약품을 21개 분변 표본에서 조사
이번 평가체제에는 약물에 대한 장내 미생물군의 영향을 체계적으로 평가하기 위한 네 단계를 포함하고 있다.
먼저 연구팀은 익명의 공여자들로부터 수집한 21개의 분변 표본을 분석해 각각의 공여자 별로 박테리아 종을 분류했다. 이를 통해 각각의 공여자들은 고유한 장내 미생물군을 가지고 있으며, 이 개인화된 미생물계 대부분이 연구팀이 개발한 실험실 배양 시스템에서 성장할 수 있다는 사실을 발견했다.
다음으로, 575개의 미국 식품의약국(FDA) 승인 약물을 대상으로 21개의 배양된 미생물군이 이 약물들을 화학적으로 변경시키는지의 여부를 시험했다.
연구팀은 여기에서 이전에 보고된 적이 없는 미생물군 유래 대사체와, 그동안 기원이 밝혀지지 않았던 부작용 관련 대사체들을 발견했다. 또 모든 공여자의 미생물군이 약물에 같은 반응을 보인 사례와 함께 일부 미생물군은 일부 약물들에만 반응을 보인 것으로 나타났다.
연구팀은 이어 배양된 미생물군에 의해 변경된 일부 약물이 어떤 메커니즘에 의해 변경됐는지를 조사했다.
어떻게 형질 전환이 일어났는지를 정확히 이해하기 위해 특정 박테리아 종과 이 박테리아의 특별한 유전자에서 화학적 변형의 원천을 추적했다.
연구팀은 이와 함께 이 방식으로 발견된 미생물군 유래 대사 반응이, 인체 약물 개발에 적용하기에 앞선 첫 단계로 쥐 모델에서 재현될 수 있음을 보여주었다.
- 김병희 객원기자
- hanbit7@gmail.com
- 저작권자 2020-06-16 ⓒ ScienceTimes
관련기사

 뉴스레터
뉴스레터